- 3% Nachlass bei Online-Bestellung
- Schnelle Lieferzeiten
- DIN ISO 9001:2015 zertifiziert
- Herstellerexpertise
- Kontaktieren Sie uns
Auschecken über Ihr Konto
Als Neukunde auschecken
Ein Konto zu erstellen hat viele Vorteile:
- Bestellungen und Sendungen verfolgen
- Alte Bestellungen einsehen
- Schneller zur Kasse gehen
Zuckeranalytik
Analytik und Trennung von Sacchariden und Derivaten
Eine effiziente und verlässliche Analytik von Lebensmitteln und deren Inhaltsstoffen hat in den letzten Jahren in zunehmenden Maße an Bedeutung gewonnen, da die Anforderungen an die Lebensmittelsicherheit und der verwendeten Rezepturen beständig gestiegen sind. Ein großer Bereich der Lebensmittelinhaltsstoffe sind die Kohlenhydrate. Bei deren Analytik geht es um die Trennung von Oligo– und Polysacchariden, Zuckern, Zuckeralkoholen, deren Abbauprodukte und Ersatzstoffe (z. B. Zuckeraustausch– oder Süßstoffe). Neben der Lebensmittelbranche ist die Untersuchung von Holz– und Pflanzeninhaltsstoffen ein weiteres großes Anwendungsfeld der Kohlenhydratanalytik.
Produkte
Technische Daten
Die stationären Phasen bei der Analytik von Sacchariden
Für die Analytik von Kohlenhydraten werden meistens polymerbasierte Materialien verwendet, die an der Oberfläche entweder mit Amino– oder Sulfonsäuregruppen (-SO3X) modifiziert sind. Das Gegenion (X) der Sulfonsäuregruppen kann dabei unterschiedlicher Art sein, weil damit die Selektivität der Säule beeinflusst werden kann. Im einfachsten Fall ist dies ein Wasserstoffion (X=H+). Weitere verwendete Gegenionen sind Kalzium (X=Ca2+), Blei (X=Pb2+), Kalium (X=K+) oder Natrium (X=Na+). Mehr Informationen zum sogenannten Ligandenaustauschmechanismus können unter der Ligandenaustauschchromatographie gefunden werden.
Mitunter werden auch andere Modifizierungen des Basismaterials für die Trennung von Kohlenhydraten verwendet, z. B. Ammonium-, Carboxyl- oder Diolgruppen.
Beteiligte Trennmechanismen
In Abhängigkeit von der stationären und der mobilen Phase können unterschiedliche Trennmechanismen zum tragen kommen, wobei während einer Trennung oft mindestens zwei davon parallel ablaufen:
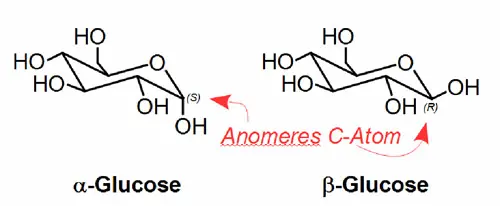
Die Trennung von Anomeren
Als Anomere werden bestimmte Diastereomere von Zuckermolekülen bezeichnet, die sich nur am sogenannten "anomeren" Kohlenstoffatom in ihrer Konfiguration unterscheiden. Für Glucose ist dies z. B. α- und β-Glucose (siehe Abbildung). In Lösung können sich diese über offenkettige Strukturen in das jeweilig andere Anomer umwandeln. Dieser Vorgang wird als Mutarotation bezeichnet.
Anomere können in einigen Fällen via HPLC getrennt werden, bzw. es ergeben sich verbreiterte oder gesplittete Peaks. Dies ist bei der Trennung von unterschiedlichen Zuckern oft nicht erwünscht und soll unterdrückt werden. Um eine Anomerentrennung zu vermeiden gibt es die folgenden zwei Möglichkeiten:
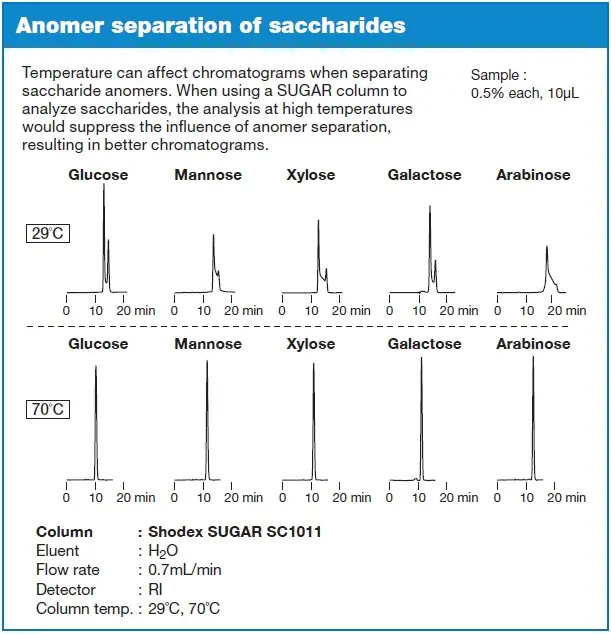
- Die Analyse wird bei erhöhten Temperaturen (≥70 °C) durchgeführt
- Die Analyse wird unter alkalischen Bedingungen durchgeführt
Die Analyse von Zuckern bei erhöhten Temperaturen wird meistens mit stationären Phasen durchgeführt, die auf der Oberfläche Sulfonate tragen. Mit Amino-Säulen dagegen kann es vorkommen, dass bereits bei Raumtemperatur keine Anomerentrennung mehr beobachtet wird, bzw. ist eine Temperaturerhöhung auf max. 40 °C notwendig ist, weil durch die schwach basischen Aminogruppen der stationären Phase im Inneren der Säule basische Bedingungen vorliegen.
Detektionsmöglichkeiten bei der Analyse von Sacchariden
Oft wird bei (Routine)-Analysen von Sacchariden der Brechungsindexdetektor (engl.: refractive index detector, RI-detector) eingesetzt. Dieser ist sehr vielseitig einsetzbar, da die Analyten weder elektrische Leitfähigkeit noch UV-Aktivität aufweisen müssen. Nachteile im Vergleich zu anderen Detektionsmöglichkeiten ist die relativ geringe Empfindlichkeit und Selektivität. Für eine Gradientenelution ist der RI-Detektor ebenfalls nicht geeignet, da sich mit der Änderung der Eluentenzusammensetzung auch der Brechungsindex ändert.
Wenn die Analyten UV- bzw. fluoreszenzaktiv sind, kann ein UV- bzw. Fluoreszenzdetektor verwendet werden. Diese weisen eine hohe Empfindlichkeit und Selektivität auf. Weitere verwendete Detektoren für die Saccharidanalytik sind der ELSD, der CAD oder MS-Detektoren. Diese weisen extrem hohe Empfindlichkeiten und Selektivitäten auf und sind darüber hinaus sehr vielseitig einsetzbar. Nachteil dieser Detektorarten ist der vergleichsweise hohe Preis.
Applikationen
Ligandenaustausch Trennung von Zuckern und Zuckeralkoholen mit Concise CarboSep CHO 87MM
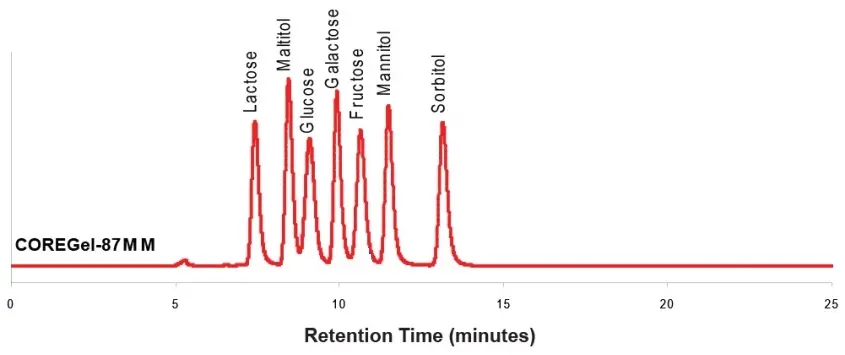
Peakidentitäten
1. Lactose 2. Malitol 3. Glucose 4. Galactose 5. Fructose 6. Mannitol 7. Sorbitol
Testbedingungen
Säule: CarboSep CHO 87MM 300x7.8mm, 8µm
Mobile Phase: Wasser
Flussrate: 0.6 mL/min
Temperatur: 80 °C
Detektion: RI

HILIC Trennung von Zuckern mit Macherey-Nagel Nucleosil Carbohydrate
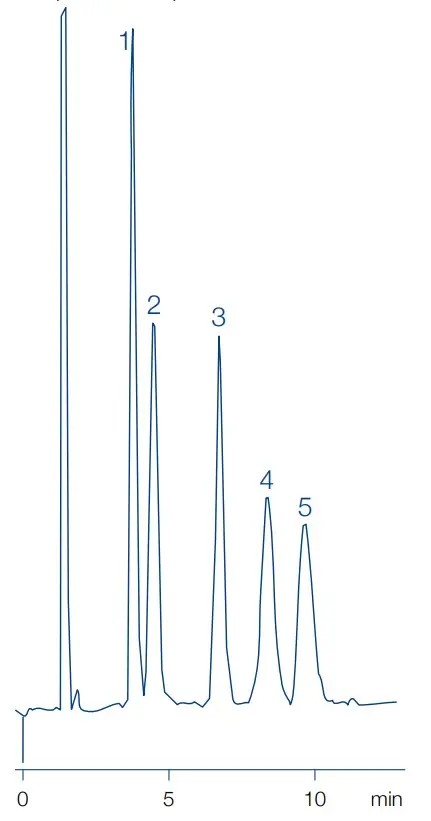
Peakidentitäten
1. Fructose 2. Glucose 3. Saccharose 4. Maltose 5. Lactose
Testbedingungen
Säule: Nucleosil Carbohydrate 250x4.0mm, 10µm
Mobile Phase: 79/21 Acetonitril/Wasser
Flussrate: 2 mL/min
Temperatur: 25 °C
Detektion: RI
Injekltionsvolumen: 10 µL

Downloads
Concise
HPLC - Ligand Exchange:
- CarboSep CHO 411, 20µm
- CarboSep CHO 682, 7µm
- CarboSep CHO 611, 10µm
- CarboSep CHO 611OH, 10µm
- CarboSep CHO 620, 10µm
- CarboSep CHO 782, 7µm
- CarboSep CHO 882, 7µm
- CarboSep CHO 882 FA, 7µm
- CarboSep CHO 87C FA, 8µm
- CarboSep CHO 87 MM, 8µm
- CarboSep USP L19, 8µm
- CarboSep CHO 820, 9µm
- CarboSep CHO 87C FA, 9µm
- CarboSep CHO 87C, 9µm
- CarboSep CHO 87K, 9µm
- CarboSep CHO 87N, 9µm
- CarboSep CHO 87P, 9µm
- Concise Transgenomic Carbohydrate Analysis Applications
- Concise Transgenomic CARBOSep CHO-620 CA Determination of Endogenous Glucose in Human Nerve Tissues Applications
- Concise Transgenomic CARBOSep Carbohydrate Separations Applications
- Concise Transgenomic Carbohydrate Analysis Applications
- Concise Transgenomic Carbosep CHO-87c Semi-Prep
- Concise Ttransgenomic CarboSep CHO-620
- Concise Transgenomic CarboSep CHO 682-2 Sugars and Sugar Alcohols Applications
- Concise Transgenomic CarboSep CHO-682
- Concise Transgenomic CarboSep CHO-782
- Concise Transgenomic CarboSep CHO-820
- Concise Transgenomic CoreGel-87C Galactose and Tagatose Applications
- Concise Transgenomic Coregel ORH-801 FA
Macherey-Nagel
HPLC - HILIC:
- Nucleosil Carbohydrate, 10µm
- Nucleodur 100-5 NH2-RP, 5µm
HPLC - Ligand Exchange:
- Nucleogel Sugar 810 Ca
- Nucleogel Sugar CA
- Nucleogel Sugar Pb
- Nucleogel Sugar Na
HPLC - Ion Exclusion:
- Nucleogel Sugar 810 H
- Nucleogel ION 300 OA
Merck Supelco
HPLC - Ligand Exchange:
- Supelcogel K, 9µm
- Supelcogel Pb, 9µm
- Supelcogel Ca, 9µm
- Supelcogel C-611, 9µm
- Supelcogel Ag1, 9µm
- Supelcogel Ag2, 9µm
HPLC - Ion Exclusion:
- Supelcogel H, 9µm
- Supelcogel C-610H, 9µm
HPLC - HILIC:
- Supelcosil LC-NH2, 5µm
Mitsubishi
HPLC - Ligand Exchange:
- MCI GEL CK08S, 11µm
- MCI GEL CK08E, 9µm
- MCI GEL CK08EC, 9µm
HPLC - Ligand Exchange/SEC:
- MCI GEL CK04S, 11µm
- MCI GEL CK04SS, 11µm
- MCI GEL CK02A, 20µm
- MCI GEL CK02AA, 20µm
HPLC - Ion Exclusion:
- MCI GEL CK08EH, 9µm
HPLC - IEX:
- MCI GEL CA08F, 7µm
Sepax
HPLC - Ligand Exchange:
- Carbomix Ca-NP5
- Carbomix Ca-NP10
- Carbomix Pb-NP5
- Carbomix Pb-NP10
HPLC - Ion Exclusion
- Carbomix H-NP5
- Carbomix H-NP10
Shodex
HPLC - Ligand Exchange/SEC:
- Sugar SC1011, 6µm
- Sugar SP0810, 7µm
- Sugar KS-801, 6µm
- Sugar KS-802, 6µm
- Sugar KS-803, 6µm
- Sugar KS-804, 7µm
HPLC - Ligand Exchange/HILIC:
- RSpak DC-613, 6µm
- Sugar SZ5532, 6µm
- Sugar SC1211, 6µm
HPLC - HILIC:
- Asahipak NH2P
- HILICpak VG-50, 5µm
- HILICpak VT-50, 5µm
- HILICpak VN-50, 5µm
HPLC - Ion Exclusion:
- Sugar SH1011, 6µm
- Sugar SH1821, 6µm
- RSpak KC-811, 6µm
Die passende Säule für Sie - Gerne beraten wir Sie persönlich
Unsere Experten stehen Ihnen jederzeit zur Seite. Schreiben Sie unserem Team eine Nachricht. Wir melden uns zurück und beraten Sie ganz individuell.













