- 3% Nachlass bei Online-Bestellung
- Schnelle Lieferzeiten
- DIN ISO 9001:2015 zertifiziert
- Herstellerexpertise
- Kontaktieren Sie uns
Auschecken über Ihr Konto
Als Neukunde auschecken
Ein Konto zu erstellen hat viele Vorteile:
- Bestellungen und Sendungen verfolgen
- Alte Bestellungen einsehen
- Schneller zur Kasse gehen
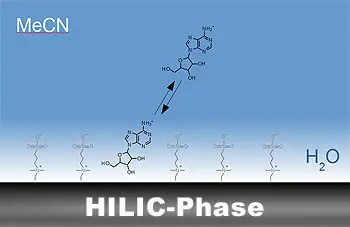
Hydrophile Interaktionschromatographie (HILIC)
Die hydrophile Interaktionschromatographie (HILIC) kann für sehr polare Analyten, die in der Umkehrphasen-Chromatographie kaum Retention erfahren und in der Normalphasen-Chromatographie aufgrund der starken Wechselwirkungen zur stationären Phase nicht eluiert werden können, eine gute Alternative als Trenntechnik sein. HILIC kombiniert die Prinzipien der Normalphasen- und Umkehrphasenchromatographie, indem sie eine polare stationäre Phase verwendet und mit organisch-reichen mobilen Phasen arbeitet, was die Analyse stark polarer Moleküle ermöglicht, die in der traditionellen Umkehrphasenchromatographie nur schwer zu trennen sind.
Die HILIC bietet mehrere Vorteile gegenüber anderen chromatographischen Methoden, darunter eine verbesserte Empfindlichkeit und Selektivität für polare Analyten, eine effiziente Kompatibilität mit Massenspektrometrie aufgrund des hohen Anteils organischer Lösungsmittel in der mobilen Phase und die Fähigkeit, sowohl polare als auch unpolare Verbindungen in einem einzigen Lauf zu analysieren. Diese Eigenschaften machen HILIC zu einem unverzichtbaren Werkzeug in der analytischen Trennwissenschaft, insbesondere für komplexe Probenmatrices, in denen polare Verbindungen von Interesse sind. Finden Sie auf unserer Seite Informationen zu den Grundlagen der HILIC Trenntechnik, Informationen zur Säulenauswahl sowie Produkte von namhaften Herstellern mit Filterfunktion der chemischen Spezifikationen. Gerne stehen wir Ihnen zur Unterstützung zur Seite - kontaktieren Sie uns einfach!
Produkte
Technische Daten
Grundlagen
Der HILIC-Trennmechanismus
Der Retentionsmechanismus beruht hauptsächlich auf der unterschiedlichen Verteilung der Analyten zwischen einer sehr polaren stationären Phase und einer weniger polaren mobilen Phase. Es besteht somit ein hydrophiles Verteilungsgleichgewicht.
Das im Eluenten vorhandene Wasser bildet an der Oberfläche der stationären Phase eine hydrophile Schicht aus, in der sich polare Analyten bevorzugt aufhalten und somit retardiert werden. Die wasserreiche Schicht der stationären Phase und die Acetonitrilreiche mobile Phase fungieren somit als Flüssig-Flüssig-Verteilungssystem. Weitere Einflüsse auf die Retention haben elektrostatische und Van-der-Waals Wechselwirkungen sowie Wasserstoffbrückenbindungen.
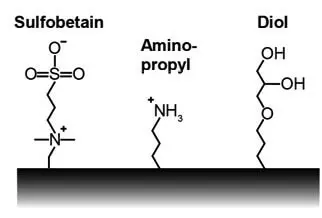
Stationäre Phasen der Hydrophilen Interaktionschromatographie HILIC
Sowohl Silika-basierte als auch Polymer-Phasen kommen für die Hydrophile Interaktionschromatographie zum Einsatz. Dabei gibt es neutrale, einfach oder mehrfach geladene Phasen:
1. HILIC-Phasen mit keiner/geringer Ionenaustauschkapazität
HILIC-Phasen mit keiner bzw. geringer Ionenaustauschkapazität (IEX-Kapazität) tragen auf der Oberfläche neutrale Modifizierungen, wie z.B. nicht-acide Hydroxy-, Amid- oder Harnstoff-Gruppen. Solche HILIC-Phasen sind bevorzugt für neutrale oder zwitterionische Analyten geeignet.
2. HILIC-Phasen mit hoher Ionenaustauschkapazität
A. Mit hoher Kationaustauschkapazität
HILIC-Phasen mit hoher Kationaustauschkapazität (CX-Kapazität) tragen auf der Oberfläche saure Gruppen, die acide Wasserstoffatome beinhalten, wie z.B. Silanole. Diese zeigen eine erhöhte Retention für basische Analyten.
B. Mit hoher Anionaustauschkapazität
HILIC-Phasen mit hoher Anionaustauschkapazität (AX-Kapazität) tragen auf der Oberfläche basische Gruppen, wie z.B. Amine. Diese zeigen eine erhöhte Retention für saure Analyten.
| HILIC-Säulentyp | Ionenaustauschkapazität | Oberflächenmodifizierung | Geeignet für... |
| 1 | Keine/geringe IEX-Kapazität | Neutral | neutrale/zwitterionische Analyten |
| 2 | Hohe CX-Kapazität | Sauer | basische Analyten |
| 3 | Hohe AX-Kapazität | Basisch | saure Analyten |
Für die HILIC-Methodenentwicklung ist es ratsam mindestens zwei, besser drei verschiedene HILIC Säulentypen einzusetzen.
Mobile Phase der Hydrophilen Interaktionschromatographie
Die mobile Phase enthält immer zu einem bestimmten Prozentsatz Wasser oder wässrigen Puffer. Acetonitril wird meist als organischer Anteil im Eluenten verwendet. Wasser ist dabei das stärker eluierende Lösungsmittel, d. h. der Starteluent (niedrigste Elutionskraft) enthält wenig Wasser (ca. 3 bis 20%). Bei Gradiententrennung wird während der Trennung der Wassergehalt langsam erhöht, wodurch die Analyten nach gegebener Zeit eluiert werden. Isokratische Trennungen sind für HILIC-Trennungen jedoch von Vorteil, da der HILIC-Trennmechanismus eine langsame Kinetik hat und bei Gradiententrennung eine längere Äquilibirierzeit im Vergleich zu RP-Säulen benötigt wird (bis zu 60-faches Säulenvolumen). Die Äquilibrierzeiten hängen maßgeblich von den Startbedingungen des Gradienten ab. Je größer die Unterschiede in der Gradientenzusammensetzung sind, um so länger ist die Äquilibrierzeit.
Hersteller von HILIC-Säulen
Mittlerweile bieten eine Vielzahl von Herstellern Säulen für HILIC an, weswegen im Folgendem nur eine Auswahl an Säulen einiger Hersteller aufgeführt wird.
| Hersteller | Name | Porengröße | Modifizierung | pH-Bereich | Oberfläche | HILIC-Säulentyp[3] |
| ACE | HILIC N | 100 Å | Polyhydroxy | 2.0–7.0 | Neutral | 1 |
HILIC A | 100 Å | Sil | 2.0–7.0 | Sauer | 2 | |
HILIC B | 100 Å | Aminopropyl | 2.0–7.0 | Basisch | 3 | |
| GL Sciences | Inertsil HILIC | 100 Å | Diol | 2.0–7.5 | Neutral | 1 |
| AMT HALO® | Penta HILIC[1] | 90 Å | Pentahydroxy | 2.0–9.0 | Neutral | 1 |
HILIC[1] | 90 Å | Sil | 1.0–8.0 | Sauer | 2 | |
| Kromasil | HILIC-D | 60 Å | Diol | 2.0–8.0 | Neutral | 1 |
| Chromanik | Sunshell HILIC-Amide[1] | 90 Å | Amide+hydrophilic Group | 2.0–8.0 | Neutral | 1 |
Sunshell HILIC-S[1] | 90 Å | Sil | 1.0–5.0 | Sauer | 2 | |
| Merck | SeQuant® ZIC®-HILIC | 100 Å, 200 Å | Sulfobetaine | 2.0–8.0 | Neutral | 1 |
SeQuant® ZIC®-cHILIC | 100 Å | Phosphorylcholine | 2.0–8.0 | Neutral | 1 | |
SeQuant® ZIC®-pHILIC | 100 Å | Sulfobetaine | 2.0–10.0 | Neutral | 1 | |
| Tosoh Bioscience | TSKgel Amide-80 | 100 Å | Carbamoyl | 2.0–7.5 | Neutral/Basisch | 1/3 |
TSKgel NH2-100 | 100 Å | Amine | 2.0–7.5 | Basisch | 3 | |
| Shodex | HILICpak VG-50[2] | 100 Å | Amino | 2.0–13.0 | Basisch | 3 |
HILICpak VT-50[2] | 100 Å | Quaternary Ammonium | 2.0–13.0 | Basisch | 3 | |
Asahipak NH2P[2] | 100 Å | Amino | 2.0–13.0 | Basisch | 3 | |
| Sepax | Polar-100 | 120 Å | Poly(ethylene glycol) | 1.5–8.0 | Neutral | 1 |
Polar-Diol | 120 Å | Diol | 1.5–8.0 | Neutral | 1 | |
Polar-Silica | 120 Å | Sil | 1.5–8.0 | Sauer | 2 | |
Polar-Imidazole | 120 Å | Imidazol | 1.5–8.0 | Basisch | 3 | |
Polar-Pyridine | 120 Å | Pyridin | 1.5–8.0 | Basisch | 3 | |
| Macherey Nagel | Nucleodur HILIC | 110 Å | Sulfobetaine | 2.0–8.5 | Neutral | 1 |
| Osaka-Soda | PC HILIC | 100 Å | Phosphorylcholine | 3.0–7.5 | Neutral | 1 |
| Thermo Scientific | Synchronis HILIC | 100 Å | Sulfobetaine | 2.0–8.0 | Neutral | 1 |
Accucore Amide-HILIC[1] | 150 Å | Polyamid | 2.0–8.0 | Neutral | 1 | |
Accucore HILIC[1] | 80 Å | Sil | 2.0–8.0 | Sauer | 2 | |
Hypersil Gold Silica | 175 Å | Sil | 2.0–8.0 | Sauer | 2 | |
Hypersil Gold HILIC | 175 Å | Polyethyleneimine | 2.0–8.0 | Basisch | 3 | |
| Supelco | Ascentis Express OH5[1] | 90 Å | Pentahydroxy | 2.0–9.0 | Neutral | 1 |
Ascentis Express HILIC[1] | 90 Å | Sil | 2.0–8.0 | Sauer | 2 | |
| Waters | BEH Amide | 130 Å, 300 Å | Amide | 2.0–11.0 | Neutral | 1 |
Cortecs HILIC | 90 Å | Sil | 1.0–5.0 | Sauer | 2 | |
BEH HILIC | 130 Å | Sil | 1.0–9.0 | Sauer | 2 | |
| Welch | Ultisil HILIC-Amide | 120 Å | Amide | 2.0–8.0 | Neutral | 1 |
| 120 Å | Sulfobetaine | 2.0–8.0 | Neutral | 1 |
[1] Fused-Core (Solid-Core) Particles, [2] Base Material: Polyvinylalcohol, [3] Erklärung siehe oben in "Grundlagen zur Hydrophilen Interaktionschromatographie"
Die passende Säule für Sie - Gerne beraten wir Sie persönlich
Unsere Experten stehen Ihnen jederzeit zur Seite. Schreiben Sie unserem Team eine Nachricht. Wir melden uns zurück und beraten Sie ganz individuell.
